中研院COVID-19小分子藥物研發
(文章更新:2020 / 04 / 17) 世界衛生組織(WHO)秘書長譚德塞已在 3 月 11 號,宣布新型冠狀病毒疫情進入「全球大流行(pandemic)」,各科技大國正如火如荼地研發特效藥物。中研院生醫轉譯研究中心副主任謝興邦指出,院內已成立抗病毒小分子藥物研究小組,與國內各研究單位共創藥物資源共享平臺,採取「老藥新用」策略,從健保學名藥下手,以期盡速找到有效藥物。跟著研之有物一起來了解!
今年 (2020年) 2月,中研院化學所陳榮傑副研究員團隊,成功合成「百毫克級」、純度達百分之 97 的瑞德西韋,且已精進到「公克級」、純度 99%。消息一出,引爆全臺熱議,因為瑞德西韋 (Remdesivir) 為當前最有希望對抗COVID-19的候選藥物。
根據 4/11《新英格蘭醫學期刊》(New England Journal of Medicine) 的最新研究,來自美國和全球的 53 名病患透過恩慈療法,接受瑞德西韋治療後,三分之二患者的病情獲得緩解,為全球衛生當局帶來正面消息,但仍需要等待控制安慰劑的雙盲試驗結果,才能確認瑞德西韋的療效。故此,全球科研單位皆同步尋找更多可能備選藥物,臺灣自不例外。
只是從零研發新藥緩不濟急,中研院COVID-19抗病毒小分子藥物小組召集人——謝興邦研究員兼副主任,擬定「老藥新用」、開發健保學名藥等策略,期待從過去藥物及時找到有效解方。今年 (2020 年) 4/10 傳出初步捷報 ,生物化學研究所梁博煌研究員從上百種化合物中篩選出新冠病毒類蛋白酶抑制劑,已證實可在體外抑制新冠病毒複製。
中研院生醫轉譯研究中心謝興邦副主任,於本次中研院COVID-19抗病毒小分子藥物小組擔任召集人,擬定老藥新用、健保學名藥優先等重要策略。 攝影│林洵安
研發藥物,從靶點開始
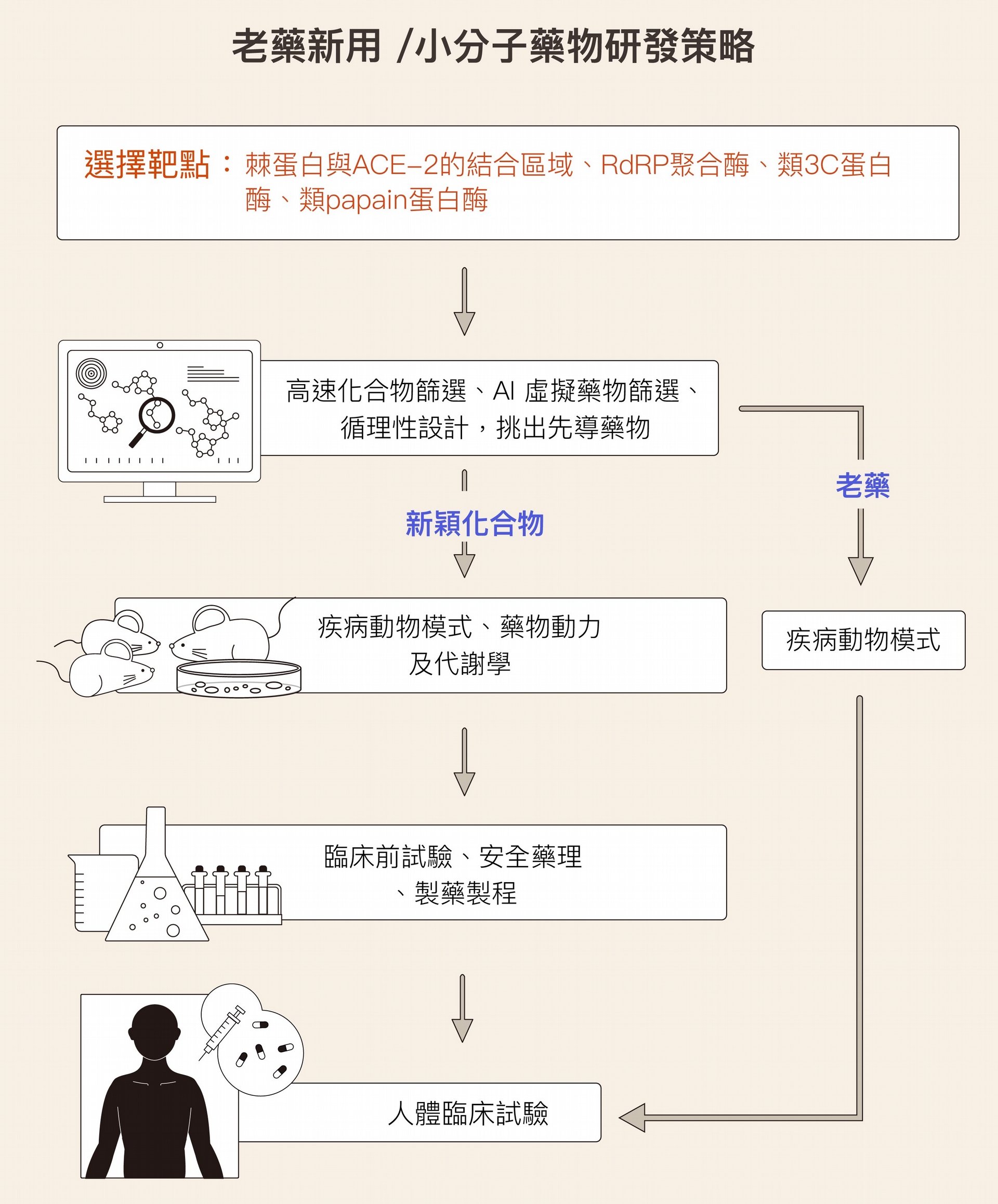
不論從零開始或老藥新用,研發抗病毒藥物的關鍵為:找到抑制病毒複製的分子或化合物,作為藥物的原料—-先導藥物(lead compound)。但尋找先導藥物並非亂槍打鳥,一開始必須先選擇特定的「靶點」。
「靶點」,即是藥物分子作用的目標,通常是指以藥物干擾「病毒複製過程的某個階段」,目的是穩定、有效地壓制病毒。謝興邦比喻,病毒入侵細胞就像小編走進中研院生醫轉譯中心,必須通過層層關卡檢查。只要其中一道關卡擋住了,小編 (病毒) 就無法完成任務了。
"從病毒複製過程,找出它的阿基里斯腱。"
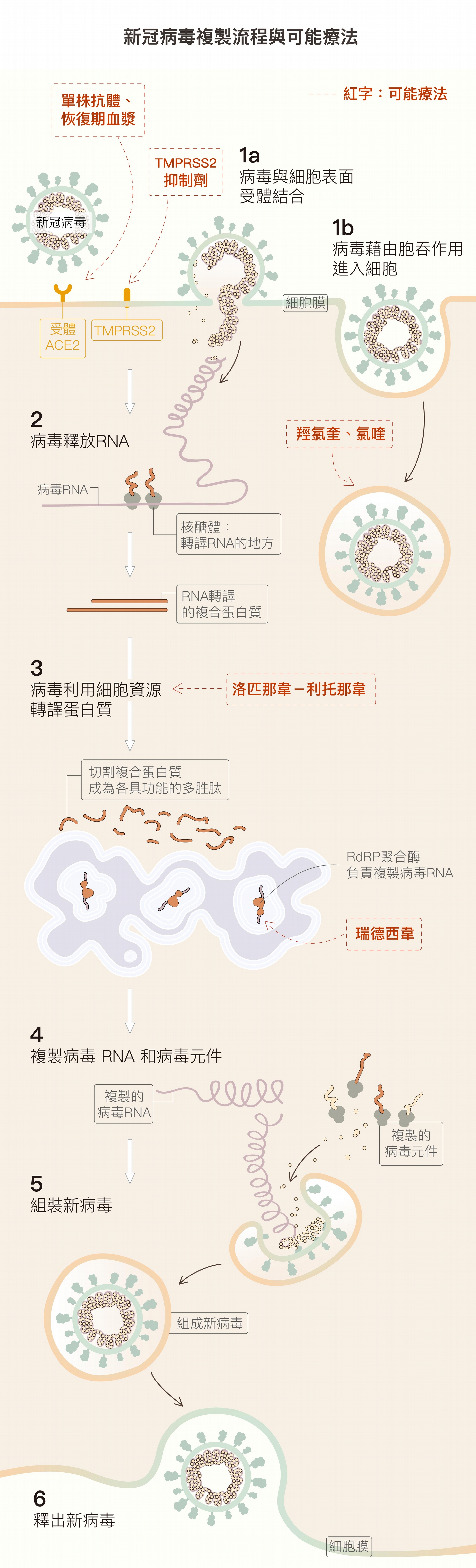
以新型冠狀病毒所屬的核糖核酸(ribonucleic acid, RNA)病毒來說,病毒藉由胞吞作用(endocytosis)進入細胞後,會先將自己分解、把遺傳物質(RNA)釋放出來,以利複製。接著,病毒會強迫宿主細胞的蛋白質合成系統,按照病毒信使 RNA(messenger RNA, mRNA),合成病毒複製所需的蛋白質「零件」與 RNA。這些蛋白質「零件」和 RNA會重新組裝成數百個完整新病毒,最後離開宿主細胞。
靶點在哪?比方說:在病毒複製過程中,是由許多蛋白酶(enzyme)負責病毒蛋白質和 RNA 的合成、切割、重組等等工作。只要想辦法抑制這些蛋白酶的活性,就可以達到「卡關」的目的。一般來說,以欺敵戰略居多,也就是使用化學結構相似的分子來代替合成時所需要的「零件」,即有機會阻斷複製流程,而這些可被矇騙的蛋白酶就成為很好的靶點。
拿著名的候選藥物瑞德西韋而言,即以病毒 RNA 複製所需 RdRp 聚合酶(RNA-dependent RNA polymerase, RdRp)為靶點,用瑞德西韋的分子冒充病毒 RNA 的零件,欺騙 RdRp 聚合酶拿它去組裝新的 RNA,使組裝完成的 RNA 宛如被塞入異物的機器,無法發揮正常功能。
(1a)病毒棘蛋白與細胞表面受體 ACE2 結合,就像用鎖插入鑰匙開門,TMPRSS2 則會幫助病毒進入細胞。 (1b)細胞膜凹陷形成囊泡,把病毒包裹起來,進入細胞。 (2) 病毒進入細胞後會釋放遺傳物質 RNA ,並切斷 RNA 以利複製。 (3) 病毒綁架細胞的蛋白質合成系統,製造病毒複製所需各種多胜肽。 (4) 有些多胜肽負責複製病毒 RNA,有些複製病毒結構的「元件」。 (5) 將複製完成的 RNA 與結構元件,組合成一個個新病毒 。 (6) 新病毒離開宿主細胞。 資料來源│謝興邦 圖說重製│黃曉君、林洵安
新藥研發:十年磨一劍的高風險賭注
選定某個靶點後,研究者再以高速化合物篩選(high throughput screening)或 AI 虛擬藥物篩選,從茫茫化合物裡挑出幾種最具有潛力的先導藥物。先導藥物再經過一連串化學修飾與活性最佳化,並進行藥物動力學評估與疾病動物模型的確效評估,一步步走到候選藥物階段。簡言之,了解該藥物被活體吸收之後,在體內如何分布、代謝,以及是否能達到期望的效果等,再進入臨床「前」試驗。
臨床前實驗包括:透過白老鼠、狗、豬、猴子甚至猩猩,進行候選藥物之安全性評估,以了解藥物是否有潛在的副作用,更重要的是找到臨床起始安全劑量。此外,還要決定該藥物除了主成分,是否添加其他「賦形劑」,以及最終藥物呈現的形式—錠劑、膠囊、噴霧或針劑等等,才能到達最後關卡—人體臨床試驗。
藥物成功上市後獲利豐厚,但中途失敗,甚至一路過關斬將,卻在臨床實驗卡關的案例不可勝數。謝興邦提到:「在美國,一種藥物從製造到臨床實驗過關、經食品藥物管理局(food and drug administration, FDA)批准上市,一般需要耗時十到十二年,花費超過十億美金。」
"新藥研發是耗時十年以上,三百億臺幣磨一劍的超高風險賭注。"
當前疫情全球延燒,花費十年從頭研發新藥,顯然緩不濟急。此刻,已通過臨床試驗核准的抗病毒藥物,或是已上市的「老藥」,可大幅縮減開發時間和花費,儼然成為最具優勢的候選者。
老藥新用:抗病毒需要即戰力
老藥如何新用?事實上,許多老藥的「副作用」常常成為另一種疾病的解方,最有名的案例就是俗稱「威而鋼」的 Sildenafil。「威而鋼本來是用來治療心臟冠狀動脈循環不良、心絞痛等症狀,但功能不彰。反而因為意外改善病人的性功能,一炮而紅。」謝興邦打趣地說道。
「這些藥品已經走過藥物代謝動力學、安全藥理評估等步驟,老藥新用時無須重來,可省下大量時間與金錢成本。」謝興邦假設:「以目前最知名的候選藥物瑞德西韋為例,中國武漢病毒研究所於今年 1月21日 或更早,即發現瑞德西韋可以抗 COVID-19 活性,原藥廠吉利德科學公司預估 4 月底取得初步數據,而症狀中度的患者實驗,預定 5 月取得臨床結果。如果解盲成功,這次老藥新用只花了 三個月左右!」。
(compassionate use,亦即對於重症患者,基於人道考量試驗新藥)使用過,在美國已進入臨床三期隨機分配 / 雙盲試驗,也是上市前的最後檢驗步驟。此階段人數規模大,受試者通常會納入不同國家,人數數百到數千位;同時會採用研究者與受試者均不知吃的是藥劑還是安慰劑的「雙盲試驗」(double-blind studies),確保藥物效力研究的準確性。
臺灣製造瑞德西韋,展現製藥硬實力
一旦未來證實瑞德西韋是有效藥物,接下來端看吉利德是否有能力大量生產,在撲滅美國疫情大火之餘出口支援其他國家。若答案是否定的,臺灣就會考慮使用原廠委託製造,或藉由強制授權的方式自行生產。
所以下一個問題是:臺灣有能力自製瑞德西韋嗎?2月中,中研院化學所陳榮傑團隊與國衛院合成團隊,分別完成瑞德西韋合成演練,「在短時間、缺乏原物料的狀況下完成艱鉅任務,代表臺灣研究團隊在有機化學之功夫紮實,具有逢山開路、遇水搭橋之能力。」不過謝興邦補充,工廠公斤級所需的反應槽配備與實驗室公克級的精密儀器配備,具有不小的差距,未來放大生產時,仍需克服設施、化學反應條件、純度,甚至雜質純化等等諸多關卡。
其次,目前吉利德公司只發布分子結構與合成步驟,尚未公布新藥查驗登記 (NDA) 時所需要詳細藥品規格,如劑量、純度、瓶裝大小,以及針劑規格等等,這些目前仍屬吉利德的營業秘密。若未來臺灣廠商希望自行製造瑞德西韋,仍需要獲得吉利德授權,以取得相關資料。
除了瑞德西韋,全球研究者也分頭篩選其他老藥,希望盡快找到解方。美國 FDA 於 3/31 已緊急授權瘧疾藥物羥氯喹 (hydroxychloroquine,HCQ ) 和氯喹 (chloroquine,CQ) 用於治療COVID-19。另一可能藥物法匹拉韋(Favipiravir),原本是日本富山化學開發對抗流行性感冒病毒,目前日本和中國也轉而嘗試對抗COVID-19。此外,治療愛滋病毒的達盧那韋(Darunavir)、抗流感病毒的阿比朵爾(Arbidol),以及日本產製的類固醇藥物,製成氣喘鼻噴劑以抑制免疫系統過度反應、舒緩發炎症狀的 Ciclesonide ,最近又發現治療頭虱的伊維菌素(Ivermectin)以及治療骨髓纖維化的 JAK1/2 抑制劑捷可衛錠 (Ruxolitinib) 等等,皆在各國如火如荼進行試驗。
那麼,臺灣中研院抗疫國家隊,又有何策略和行動呢?
從健保資料庫,尋找更多救命藥方
除了老藥新用,謝興邦認為,可優先從健保資料庫中篩選學名藥。因為專利藥物如瑞德西韋,受到智慧財產權保護,未經授權不能生產、銷售,相對麻煩。但健保資料庫有很多專利過期、可由他廠製造的「學名藥」,甚至臺灣本來就會生產的「國產藥」,可直接進入量產。
做法是:研究團隊先選定靶點之後,將健保資料庫中的所有藥物以 AI 特有計算公式進行篩選配對、排序,評估最有潛力的老藥,透過靶點篩選測試以及細胞抗病毒試驗,若老藥在細胞攻毒實驗,顯示不錯抑制活性,即有機會直接進入人體臨床試驗。
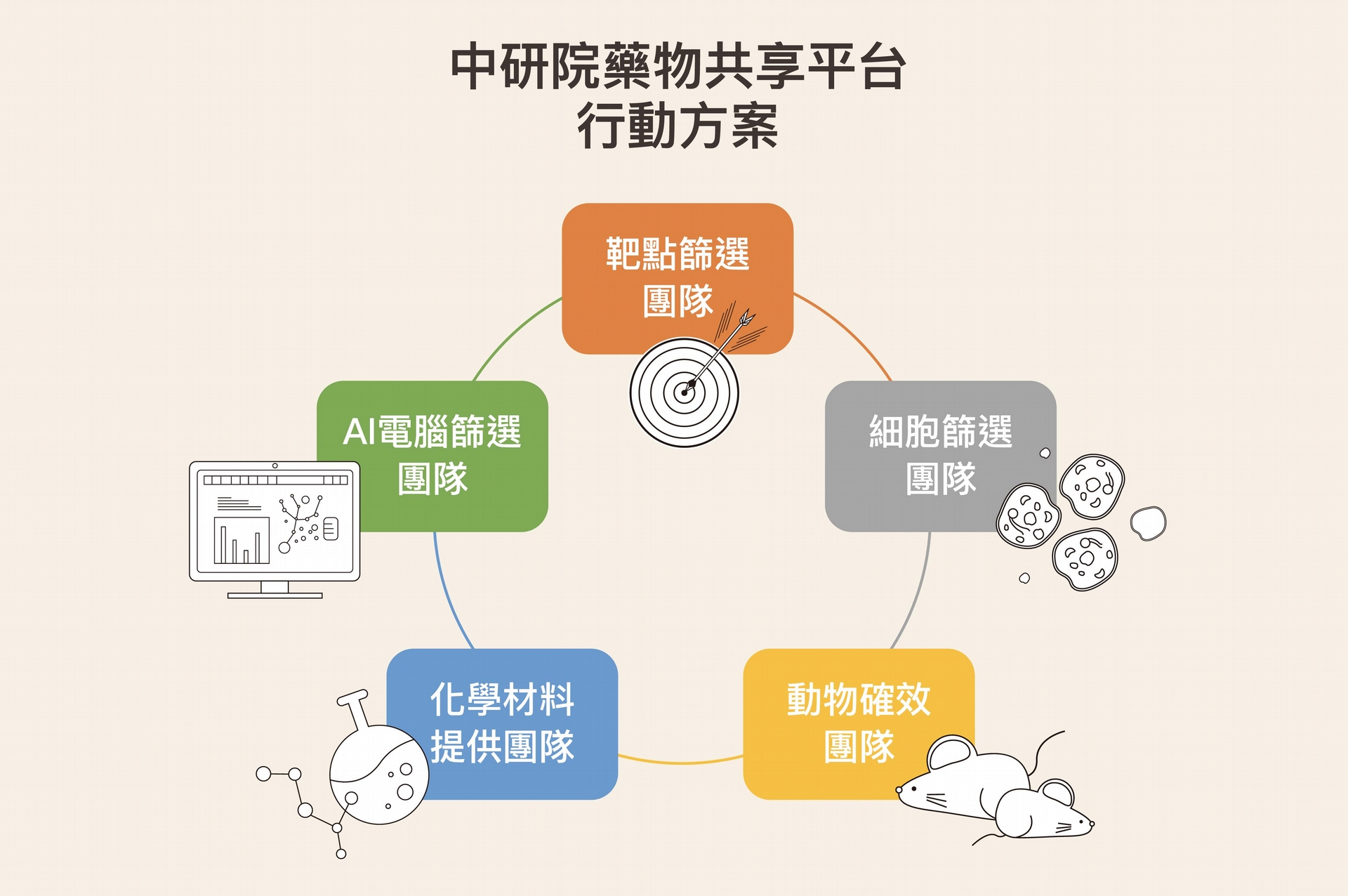
中研院抗病毒小分子藥物小組已成立藥物資源共享平臺,與其他學術單位互通研究情報,優先從抗 SARS 以及抗其他病毒的藥物下手,或是依照各種靶點篩選出來的化合物,尋找較有可能的候選藥物。「因為藥物開發牽涉專利,過去研究者多各自奮鬥;但現在國家進入緊急狀態,大家都明白必須同舟共濟,才能度過難關。」謝興邦感慨道。目前抗病毒小分子藥物小組分為五大團隊,分頭並進務求禦「毒」於國門之外。
以靶點篩選團隊為例,研究者根據先前 SARS 病毒研究,選定類 3C 蛋白酶(3C-like protease, 3CL protease)為靶點。當病毒入侵細胞後,類 3C 蛋白酶會負責切割病毒轉譯的複合蛋白質,以產生各種功能不同的多胜肽,作為病毒複製的「工具」,與 RdRP 聚合酶分屬不同關卡的靶點。中研院生化所梁博煌研究員、陽明大學黃琤副教授和高雄醫學大學李景欽教授針對關鍵蛋白酶或聚合酶建立篩選平臺。日前梁博煌已從上百種化合物中篩選出新冠病毒類蛋白酶抑制劑,並證實可在體外抑制新冠病毒複製,比已知的抑制劑強 10 倍!此外,成功大學莊偉哲教授、清華大學王慧菁副教授,則針對病毒 ACE2 受體篩選平臺尋找有效藥物。
生醫所陶秘華研究員任務是建立腺相關病毒 (adeno associated virus, AAV) 的動物模型,尋找可以直接將病毒拒於細胞外的藥物,或是病毒進入細胞後的抑制藥物。中研院詹家琮博士、臺灣大學張淑媛教授、長庚大學施信如教授和國衛院感疫所,分別建立細胞抗病毒評估試驗,例如:病毒空斑和病毒複製抑制實驗。AI 篩選平臺由臺灣大學阮雪芬教授與 AI 實驗室共同合作,中研院生醫所黃明經研究員和應科中心林榮信研究員使用生物資訊方法,進行虛擬藥物篩選。
新行冠狀病毒突變率高,雞尾酒療法可能成主流
運用老藥新用策略,謝興邦評估,全球最快幾個月內可能找到有效藥物。但面對新冠病毒的高突變率,未來可能衍生出好幾種劇本:其一是如皰疹病毒般,感染後就病毒不會被根除,而是進入「潛伏期」,一旦身體免疫力下降症狀就會復發;其二是辨識難度提高,未來當病毒突變到難以與其他疾病辨認時,一次給予不同症狀治療的雞尾酒療法,可能會成為主流。
新型冠狀病毒籠罩全球,誰都無法預測何時能撥雲見日,但可確定的是藥物研發正考驗各國科研實力。謝興邦回到中研院合成德瑞西韋的例子,「在有原料、有時間的情況下要合成藥物,對各研究團隊來說都不難,但從無到有、如此短的時間內合成藥物,唯有基礎訓練紮實者才可能脫穎而出、達成任務。」臺灣基礎科研厚積薄發,正在本次疫情發揮不凡戰力。
本文轉載自《研之有物》,一個串聯您與中央研究院的科普橋梁。