找出 ALT 癌細胞的存活機制
癌症種類很多,有些是長時間基因突變與細胞受損發炎導致,少部分癌症則好發於兒童時期。兒童癌症往往有個共通點,就是癌細胞會用同源重組方式來延長端粒,好讓自己不斷大量複製,稱為 ALT 癌細胞(替代性延長端粒癌細胞)。長期研究端粒的中央研究院分子生物研究所陳律佑副研究員,他的研究成果揭露了 ALT 癌細胞逃避人體免疫系統的關鍵路徑,目前他正與臨床醫療機構合作,擬定治療兒童癌症的一系列計畫。至於端粒是什麼?ALT 癌細胞要如何延長端粒?請跟著中研院「研之有物」的專訪內容一同探索吧!
染色體末端的「端粒」是細胞壽命的限制器,理解癌細胞如何延長端粒,對癌症治療相當重要。 圖|iStock
近 40 年來,癌症一直是國人死亡的頭號殺手,已邁入高齡社會的臺灣,癌症醫療已成為衛生福利的重要焦點。然而,罹患癌症的不只是成年人。根據衛生福利部統計資料,在 2015 年之後,癌症也是兒童非事故死亡的主要原因(1-11 歲)。
不過,成人與兒童罹患的癌症種類有所不同。成人癌症通常是大腸癌、肝癌、肺癌等,這些發生在上皮組織的癌症(carcinoma),通常是經過長時間累積基因變異與細胞損壞才會發生;至於兒童癌症,主要是中胚層癌或胚胎型癌,例如腦瘤、軟組織瘤及骨癌等,不是經由體細胞基因變異累積,通常很早就發病。
目前因為兒童癌症病例比較少,投入的研究與醫療資源也相對缺乏。然而,中央研究院分子生物研究所副研究員陳律佑,他與研究團隊從端粒研究出發,解開兒童癌症的免疫逃避機制,後續將進一步找出預防和治療的方法,這對兒童癌症患者來說,將會是一大福音。
細胞壽命的限制器:端粒
生物身體成長與傷口復原都倚賴細胞分裂,以生產新細胞來汰換老舊或受損的細胞。然而,正常細胞會有分裂次數限制,當次數逐漸達到上限時,細胞就會慢慢停止生長或走向死亡,這就是所謂的「細胞衰老」。
癌細胞不一樣,當細胞突變成癌細胞之後,就沒有分裂次數限制。不會老化的癌細胞可以無限次數分裂和增長,最後,大量癌細胞會奪去身體的營養與資源,讓病者衰弱而死。造成正常細胞與癌細胞如此迥異的命運,關鍵就在於「端粒」的使用期限。
"端粒是真核細胞染色體的保護構造。端粒的主要功能,就是維持染色體的完整性,並調控細胞分裂週期。"
端粒(telomere)是真核生物染色體末端的特殊結構,由一段重複的相同序列 DNA 與許多蛋白質組成。以人類來說,端粒的重複 DNA 序列是「TTAGGG/CCCTAA」,最長可達約 15,000 個鹼基對。
端粒(telomere)是真核生物染色體末端的特殊結構,由一段重複的相同序列 DNA 與許多蛋白質組成。以人類來說,端粒的重複 DNA 序列是「TTAGGG/CCCTAA」 圖|研之有物(資料來源|Labster)
「端粒跟染色體的關係,可以想像成鞋帶與尾端的塑膠套。」陳律佑舉例說,就像末端的塑膠套可以避免鞋帶繩逐漸鬆脫,端粒就是在染色體的端點發揮保護與區隔的功能。這樣一來,有端粒保護的染色體就不會被核酸酶降解;另外,端粒也能防止染色體彼此連結起來。
陳律佑指出,「如果沒有端粒,染色體的末端就會被細胞辨認為處於『斷掉』的異常狀態,於是 DNA 修復蛋白質就會把染色體末端相互連結,來試圖『修補』染色體。」
"端粒的存在,確保了染色體不會錯誤連接、持續消耗,也確保染色體不會在複製及分裂時斷裂、遺失。"
But!就像鞋帶塑膠套會逐漸磨損一樣,端粒也沒辦法無限期地保護染色體。每經過一次細胞分裂,端粒就會縮短數十到數百個鹼基,因此隨著分裂次數越多,端粒就會越來越短。
正常細胞每經過一次細胞分裂,染色體的端粒就會縮短數十到數百個鹼基,因此隨著分裂次數越多,端粒就會越來越短,直到失去保護染色體的功能。 圖|研之有物(資料來源|Labster)
當端粒縮短到一定長度就會失去保護染色體的功能,使細胞產生 DNA 損害反應,或出現相互連接的染色體,接著因細胞分裂而導致 DNA 斷裂的現象,這些狀況都將使細胞停止生長,進入衰老。此時身體會啟動細胞凋亡(apoptosis)的機制,將無法再分裂的老化細胞汰除。
延長細胞壽命的恢復道具:端粒酶
隨著端粒縮短,體細胞持續老化,直到端粒無法使用,細胞生命就走到盡頭。在體細胞裡,端粒縮短是不可逆的過程,細胞衰老無法停止。
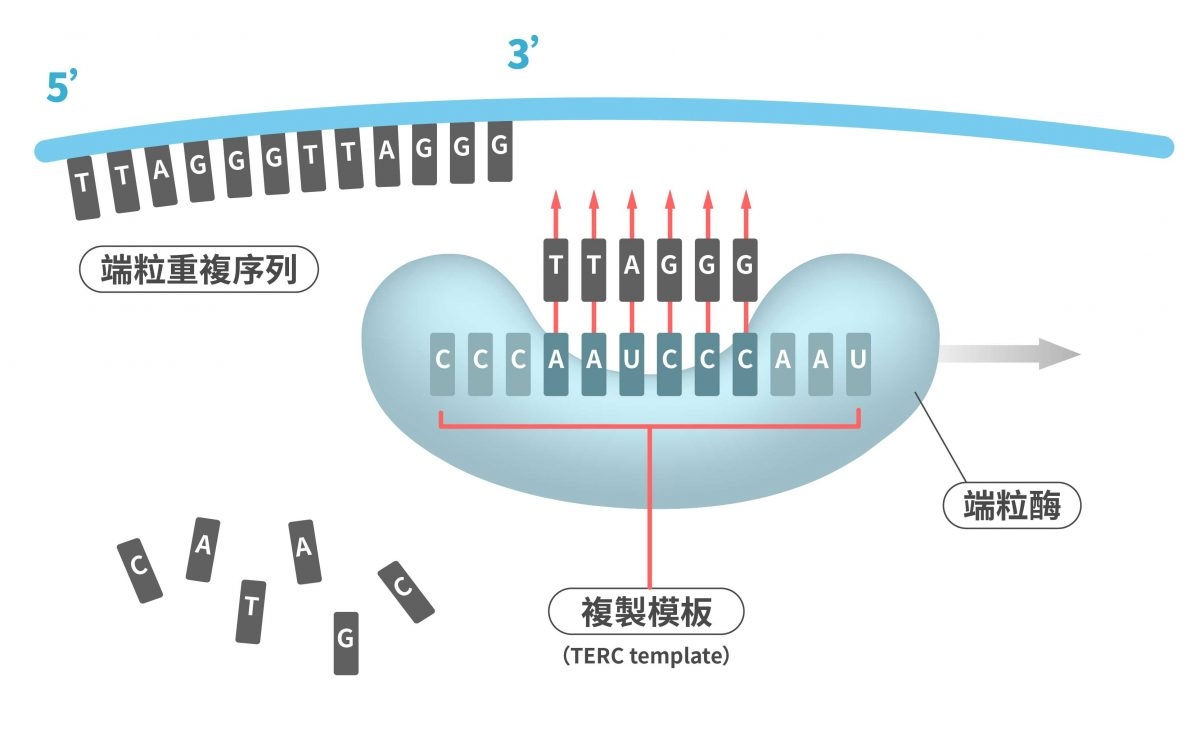
然而,在生殖細胞跟胚胎幹細胞中,有種酵素叫作端粒酶(telomerase),可以把「TTAGGG」序列添加回到端粒,所以端粒可以補充、維持,甚至變得更長!因此相較於體細胞,生殖細胞與胚胎幹細胞可以有更多的分裂次數。
在生殖細胞跟胚胎幹細胞中有端粒酶,端粒酶可以延長端粒,維持端粒的序列長度。 圖|研之有物(資料來源:Cardiovascular Research)
其實,成體幹細胞也有端粒酶,但數量不足,因此修補端粒的速度趕不上消耗速度,端粒會逐漸縮短。所以即使帶有端粒酶,但成體幹細胞還是會衰老,只是速度比體細胞慢些。
至於人體的生殖細胞裡,端粒酶數量就很足夠,而且一直存在。「研究發現,有些年長者生殖細胞染色體的端粒長度,甚至比年輕人的端粒還要長。」陳律佑提到。在端粒酶的幫助之下,生殖細胞就可以一直分裂,以產生精子。
端粒的自我延長:DNA 同源重組
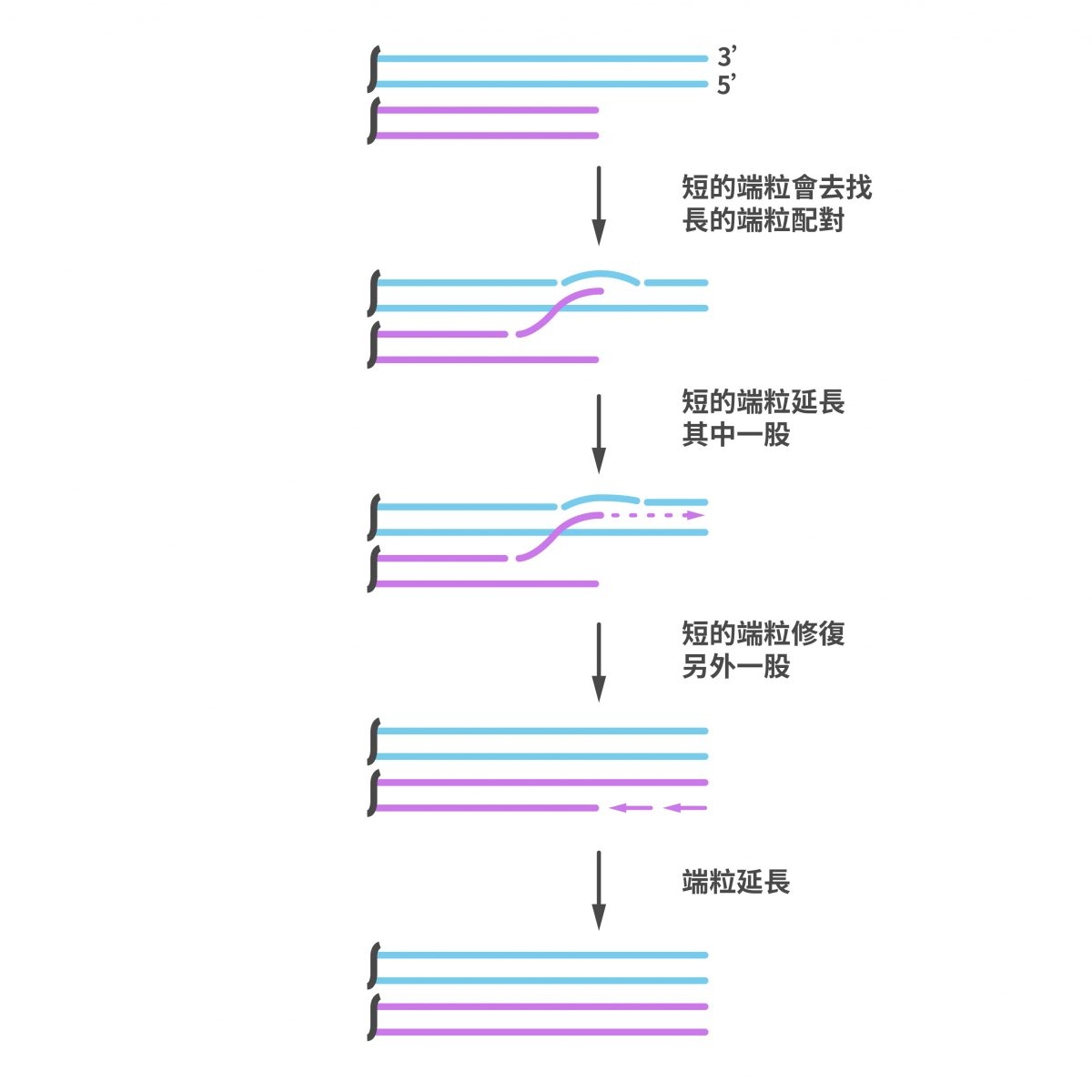
除了端粒酶,真核生物還有另一種延長端粒的方法,利用細胞內 DNA 同源重組(Homologous recombination)來進行。「 藉由 DNA 同源重組的機制,較短的端粒,會去找另一條來配對,接著 DNA 聚合酶會以長的那條染色體當模板,幫助短的端粒加長。」陳律佑說。
"DNA 同源重組機制也可以延長端粒,但平常被抑制住了。"
不過,在一般人體體細胞裡,是不會觀察到端粒 DNA 同源重組的,所以體細胞還是沒有辦法藉此延長端粒;而幹細胞或是被活化的免疫細胞中偶爾才會發生。同樣是真核生物的酵母菌平常也都是藉由端粒酶延長端粒。
早期端粒領域的研究發現,去除端粒酶的酵母菌,成長過程中端粒雖如預期般逐漸縮短,然後酵母菌慢慢地停止生長。但持續培養一段時間後,酵母菌居然能夠使用 DNA 同源重組來延長端粒,又重新開始生長。
陳律佑表示, DNA 同源重組機制在生物演化過程中,可能扮演重要的角色,但不知道什麼原因,這個機制在細胞中是被抑制住的。「其中一種可能性是,DNA 同源重組機制被大量活化可能會給細胞帶來負擔或是不好的後果,所以才被抑制住。但這些還需要進一步研究。」陳律佑說。
DNA 同源重組機制也可以延長端粒,同一對染色體中,比較短的端粒,會去找另一條較長的端粒配對,接著 DNA 聚合酶會以長端粒的序列當複製模板,加長短端粒。 圖|研之有物(資料來源|Trends in Biochemical Sciences)
癌細胞:「端粒酶 vs. DNA 同源重組,選哪個?」
癌細胞之所以不會走向細胞凋亡的結局,關鍵就在於擁有延長端粒的能力。癌細胞跟生殖細胞一樣,擁有充份的端粒酶活性。所以癌細胞在分裂過程中,消耗了的端粒還是能持續補充回來,癌細胞因此擁有無限分裂次數的能力,一直保持在最佳生理狀態。
不過,並非所有種類癌細胞都是端粒酶富翁。大約有 80%~90% 的癌症,其癌細胞中有大量端粒酶可以修補端粒;其餘 10%~20% 的癌症,例如兒童腦瘤、軟組織瘤及骨癌等癌症,則主要是用同源重組機制來延長端粒。
"使用 DNA 同源重組機制延長端粒的癌細胞,稱為替代性延長端粒(alternative lengthening of telomeres)癌細胞,簡稱 ALT 癌細胞。"
一般的情況下, DNA 同源重組機制在體細胞中會被抑制,但 ALT 癌細胞中的抑制作用消失了,於是 DNA 同源重組機制就能順利運行,延長癌細胞端粒、讓癌細胞生生不息。
不正常掉落的基因碎屑:ECTR DNA
當細胞啟用 DNA 同源重組機制來延長端粒時,會產生許多副產物:染色體外端粒 DNA(extrachromosomal telomere repeat DNA,簡稱 ECTR DNA)。「簡單來說,就是在端粒加長時,DNA 同源重組機制出現錯誤,讓 DNA 片段掉出來,變成 ECTR 。」陳律佑解釋。
也就是說,端粒增長時,失控的 DNA 同源重組使端粒 DNA 斷裂,進而形成長短不一、呈片段狀的 ECTR ;另一方面,端粒 DNA 尋找延長模板時,也可能反折,用自己的序列複製,端粒會彎曲形成一個圓圈來複製序列,這時偏差的 DNA 同源重組反應也會讓 DNA 斷掉, 變成圓圈的 ECTR。
總之,DNA 同源重組機制產生長短與形狀不一的 ECTR ,會從端粒附近慢慢向外游離,接著從細胞核一路漂到細胞質。
"正常的體細胞,細胞質裡不會有遺傳物質。只要在細胞質中觀察到 ECTR DNA,表示該細胞的端粒正在進行同源重組,很可能已經突變成 ALT 癌細胞。"
因此陳律佑認為,ECTR DNA 可以作為 ALT 癌細胞的一種生物標記。
感知異常的基因碎屑,用反應路徑召喚免疫大軍
在真核生物的細胞裡頭,只有兩個部位會出現 DNA ,一個是細胞核,存放著大量重要的遺傳物質;另一個是細胞能量工廠粒線體,它擁有自己的 DNA 。正常情況下,在細胞質裡不應該有遺傳物質出現。
「細胞質出現遺傳物質,大部分是受到病原入侵。」陳律佑指出,例如病毒感染細胞後,會把自己的遺傳物質注射進到細胞質,並且利用宿主細胞資源來複製所需的各種零件與遺傳物質,重新組裝成更多病毒顆粒。
當細胞遭遇入侵者時,會啟動一連串免疫反應來抑制外來入侵者。然而,從偵測 DNA 到啟動免疫反應中的詳細機制,多年前都還是眾說紛紜,近幾年才逐漸明朗。
"陳律佑表示,cGAS-STING 反應路徑(cGAS-STING pathway),就是細胞質游離 DNA 啟動免疫機制的關鍵。"
cGAS-STING 路徑,是藉由細胞質裡的一種合成酶 cGAS(cyclin GMP-AMP synthase)來偵測並結合游離在細胞質中的 DNA 。結合後,cGAS 會被活化,接著會把三磷酸腺苷(ATP)與三磷酸鳥苷(GTP)合成一種環狀二核苷酸(cGAMP)。
這種分子會進一步啟動干擾素刺激因子 STING(stimulator of interferon genes)以及後續的連鎖反應,誘導免疫細胞產生干擾素、細胞激素等物質,並引起發炎等非專一性的先天免疫反應。
這樣一來,感染細胞的一切運作會被強制停止。原本受病毒感染的細胞,其內部幫助病毒複製零件的生產線就會被切斷。同時,被干擾素吸引來的樹狀細胞(dendritic cell)、巨噬細胞(macrophage)等先天免疫細胞,也會清除被感染的細胞。
陳律佑表示,cGAS-STING 反應路徑(cGAS-STING pathway),就是細胞質游離 DNA 啟動免疫機制的關鍵。 圖|研之有物
ECTR DNA 本來應該要啟動免疫系統,但是⋯⋯
ECTR DNA 也是不該在細胞質出現的基因碎屑。當 DNA 同源重組機制因為未知原因,被細胞重新啟動來延長端粒時,作為副產物的 ECTR 會從細胞核往外漂到細胞質。
正常來說,細胞偵測到細胞質不應有的遺傳物質片段 ECTR,就會判定異常並發出警報,經由 cGAS-STING 路徑啟動免疫連鎖反應。
等等!既然 ECTR 會觸發 cGAS-STING 路徑,那麼使用 DNA 同源重組機制延長端粒的 ALT 癌細胞不是就會被免疫系統察覺和消滅才對嗎?
實際上並沒有。
陳律佑指出,研究團隊的實驗結果顯示,在正常人類細胞中,ECTR 的累積的確會活化 cGAS-STING 蛋白感知路徑,促使細胞分泌出干擾素,激發先天免疫反應並抑制細胞生長。
但在 ALT 癌細胞株裡面,cGAS-STING 蛋白的感知反應消失了!不論是 ECTR 或是其他細胞質游離 DNA,都不會開啟 cGAS-STING 路徑,免疫反應也就不會啟動。於是,癌細胞就能逃避免疫系統的攻擊,並肆無忌憚地不斷增生。
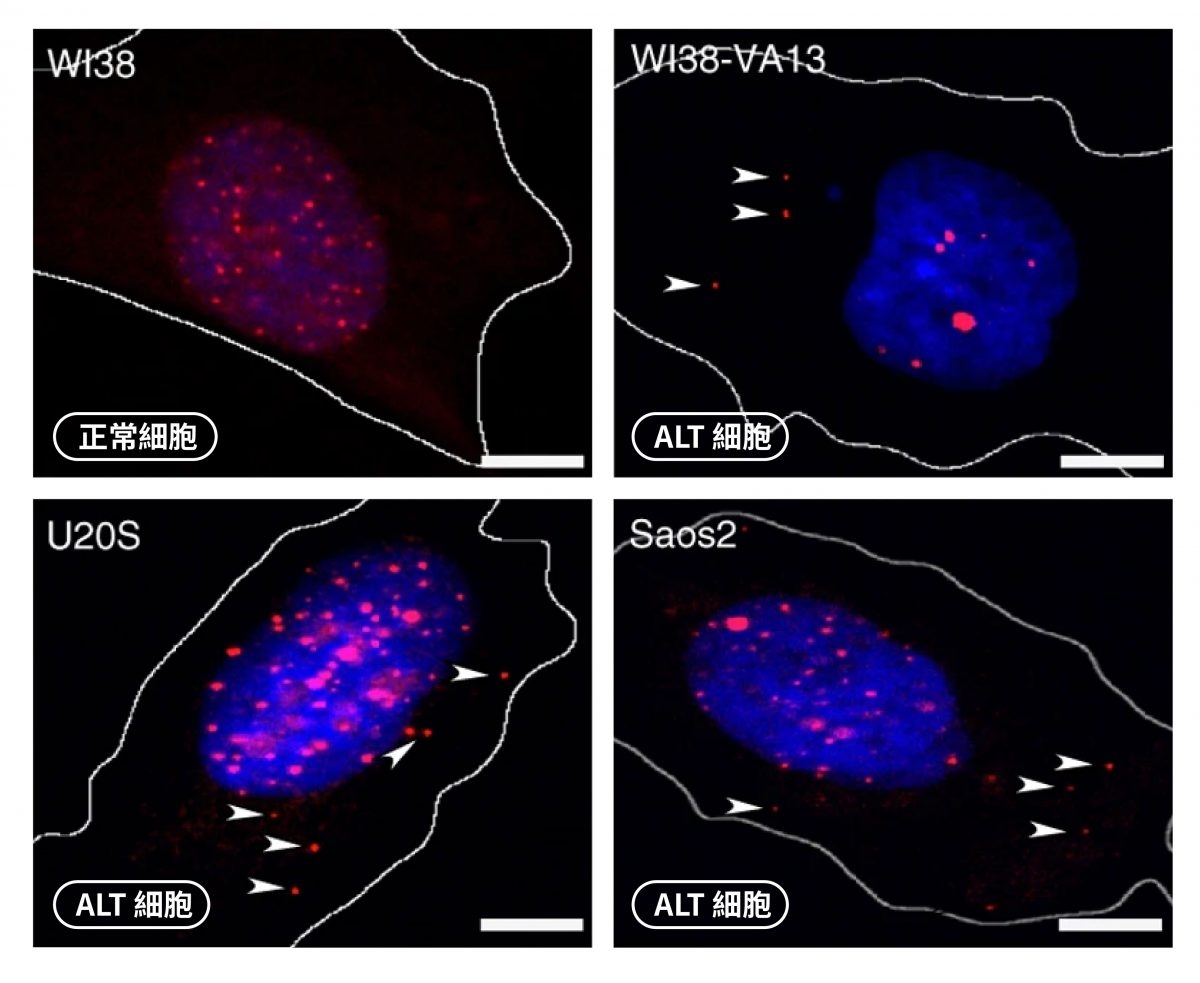
正常肺纖維母細胞(WI38),細胞質沒有 ECTR。但是 ALT 癌細胞(WI38-VA13、U2OS、Saos2)的細胞質存在 ECTR(箭頭處),ECTR 的存在沒有成功啟動免疫系統。 圖|研之有物(資料來源|陳律佑)
「我們設計了體外的癌細胞實驗,證明出 STING 蛋白在 ALT 癌細胞株裡被抑制。」陳律佑表示,目前 STING 蛋白被抑制的原因還有待進一步實驗來探討,但團隊已經確認 ECTR 並沒有啟動 cGAS-STING 路徑、沒有激發免疫反應,都是因為 STING 蛋白消失的緣故。
“讓 ALT 癌細胞逃脫的秘密,就是消失的 STING 蛋白。”
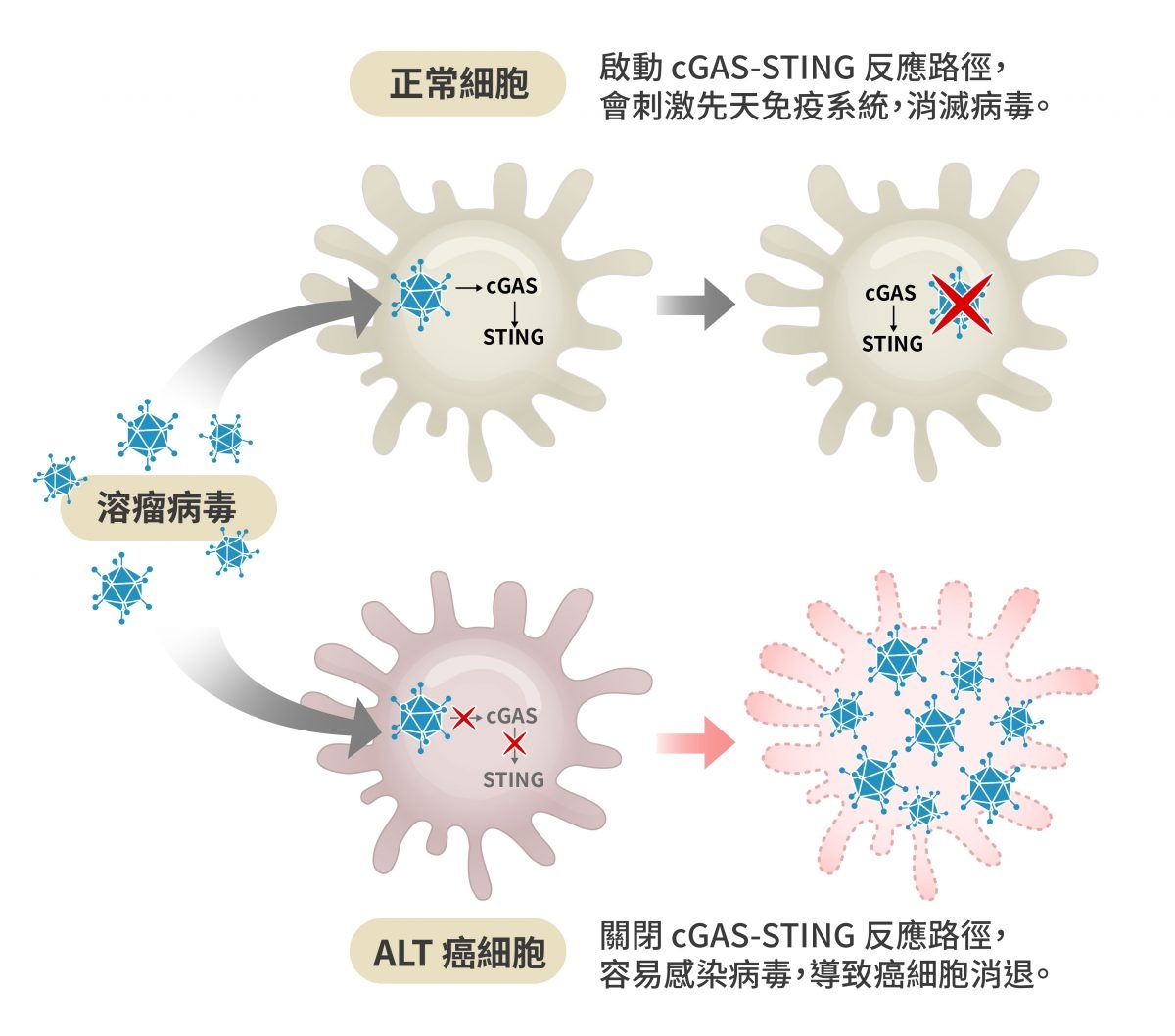
但是,即使促進 STING 蛋白的表現,也不能保證能夠解決癌細胞,因為免疫系統很複雜,促進免疫表現也可能誘發免疫風暴。目前臨床已有的溶瘤病毒療法(oncolytic virus therapy)是一個可行的方案,因為 ALT 癌細胞關閉了 cGAS-STING 反應路徑,很容易被病毒感染,可以透過病毒專一性感染癌細胞,讓癌細胞消退(regression)。
雖然還有很多謎題有待釐清,例如 ECTR DNA 如何觸發 cGAS-STING 路徑、影響癌症生成等。然而陳律佑團隊的研究成果,已經對於兒童癌症治療有重要貢獻和知識引導作用,特別是腦瘤、軟組織瘤及骨癌等 ALT 癌症,有助於後續人們針對 ALT 癌症開發更有效的治療方法。陳律佑最近與和信治癌中心醫院的醫師陳榮隆展開合作,結合中研院豐沛的研究成果與前線臨床醫療,讓更多病者可以得到妥善照護。
溶瘤病毒療法是 ALT 癌症的可行療法之一,因為 ALT 癌細胞關閉了 cGAS-STING 反應,很容易被病毒感染,可以透過病毒專一性感染癌細胞,讓癌細胞消退。 圖|研之有物(資料來源|EMBO Reports)

本文轉載自中央研究院《研之有物》,為中研院廣告。
採訪撰文|林承勳
責任編輯|簡克志
美術設計|蔡宛潔