該生技公司的首要候選疫苗剛在美國進入臨床試驗第三階段。閱讀本文了解為何這種疫苗技術很有潛力──但仍不乏抱持懷疑態度的人。
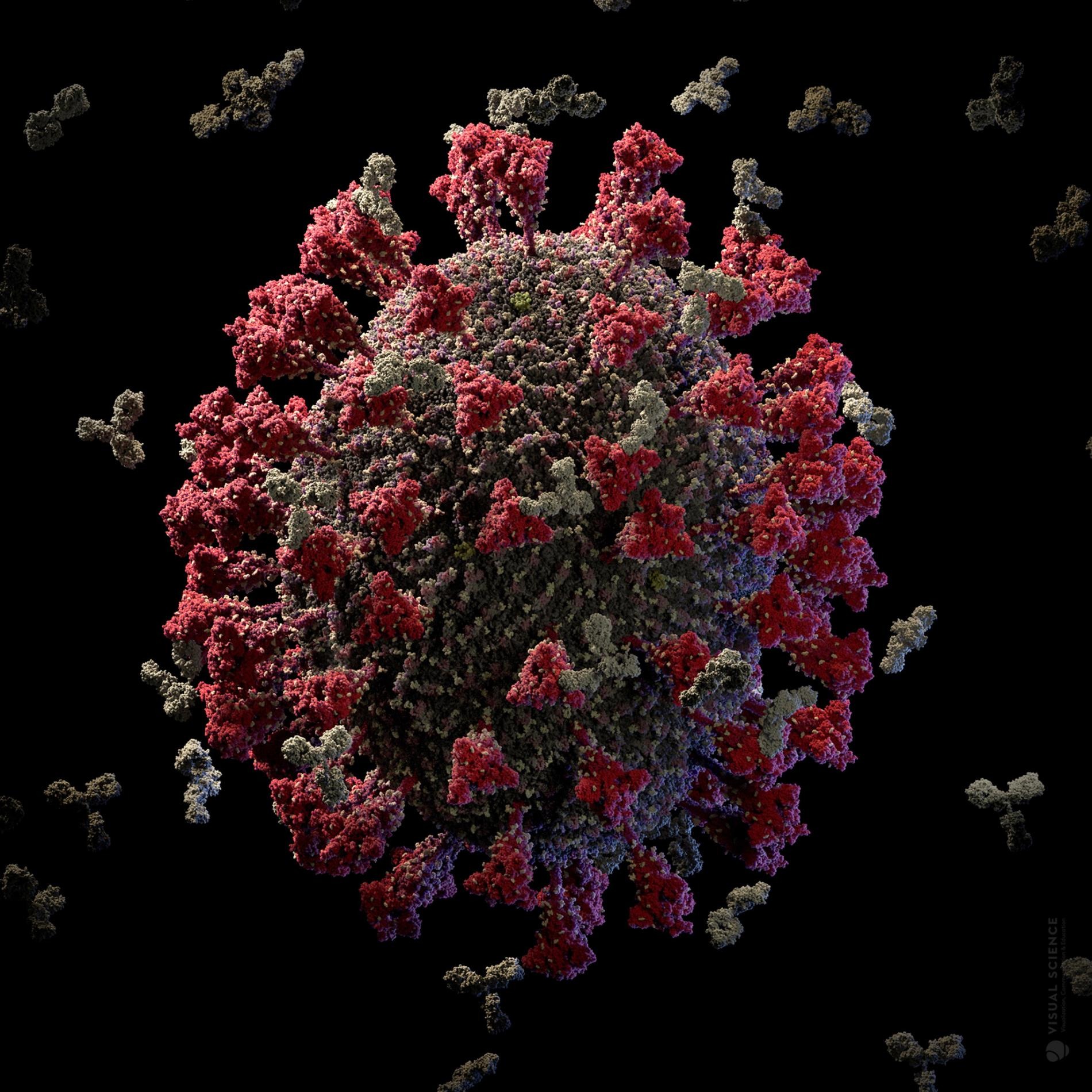
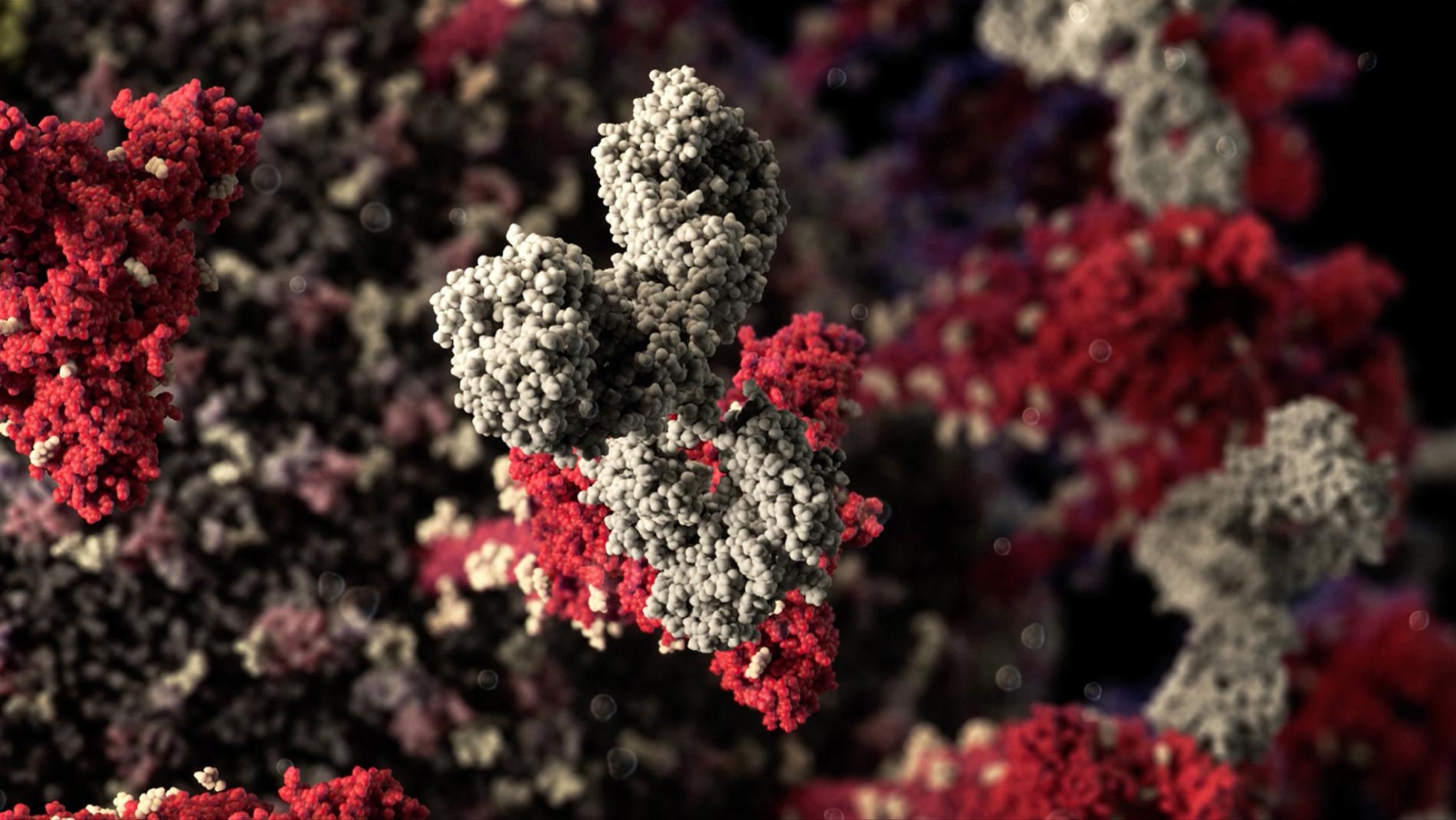
SARS-CoV-2病毒的表面覆蓋著棘蛋白(紅色)。莫德納的傳訊RNA(mRNA)疫苗會教導人體辨識這些棘蛋白,讓人體能生產一批中和抗體(白色),在冠狀病毒造成感染之前就阻止它。MODEL AT ATOMIC RESOLUTION IN BY VISUAL SCIENCE
上週有一種很有潛力的冠狀病毒候選疫苗達到另一個里程碑:莫德納醫藥公司(Moderna Therapeutics)開始進行臨床試驗第三階段。這件事代表著該生技公司與美國國立衛生研究院(National Institutes of Health)──雙方合作進行臨床試驗──離將疫苗帶給大眾與商業市場只有一步之遙。
COVID-19大流行造成將近七個月的全球死亡與經濟停擺之後,大眾正焦急等待著重返正常生活的一線希望。這在一定程度上解釋了人們對疫苗研發的持續狂熱,包括牛津大學的一種候選疫苗,它最近在巴西也進入了臨床試驗第三階段。
莫德納在創紀錄的63天內就將候選疫苗從麻薩諸塞州劍橋的實驗室推進到人類臨床試驗,使該疫苗佔據領先優勢。該公司在5月18日宣布了初步研究結果,顯示健康受試者會對他們開發的mRNA疫苗產生反應,製造「中和性抗體」(neutralizing antibodies)。抗體是免疫系統為了避免冠狀病毒感染而製造的關鍵前哨。專家很快就指出,這些研究結果在總共45人的試驗中只適用於八人。該公司又花了兩個月發表一份經過同儕審查的研究報告,具有充足資訊來判定第一階段的受試者是否具有保護性免疫反應,而免疫學家普遍認為保護性免疫反應涵蓋的不只是製造抗體而已。
莫德納發表的詳細資料顯示,該公司可能正在達成某種前所未有的成就:為第一種人用mRNA疫苗取得認證。
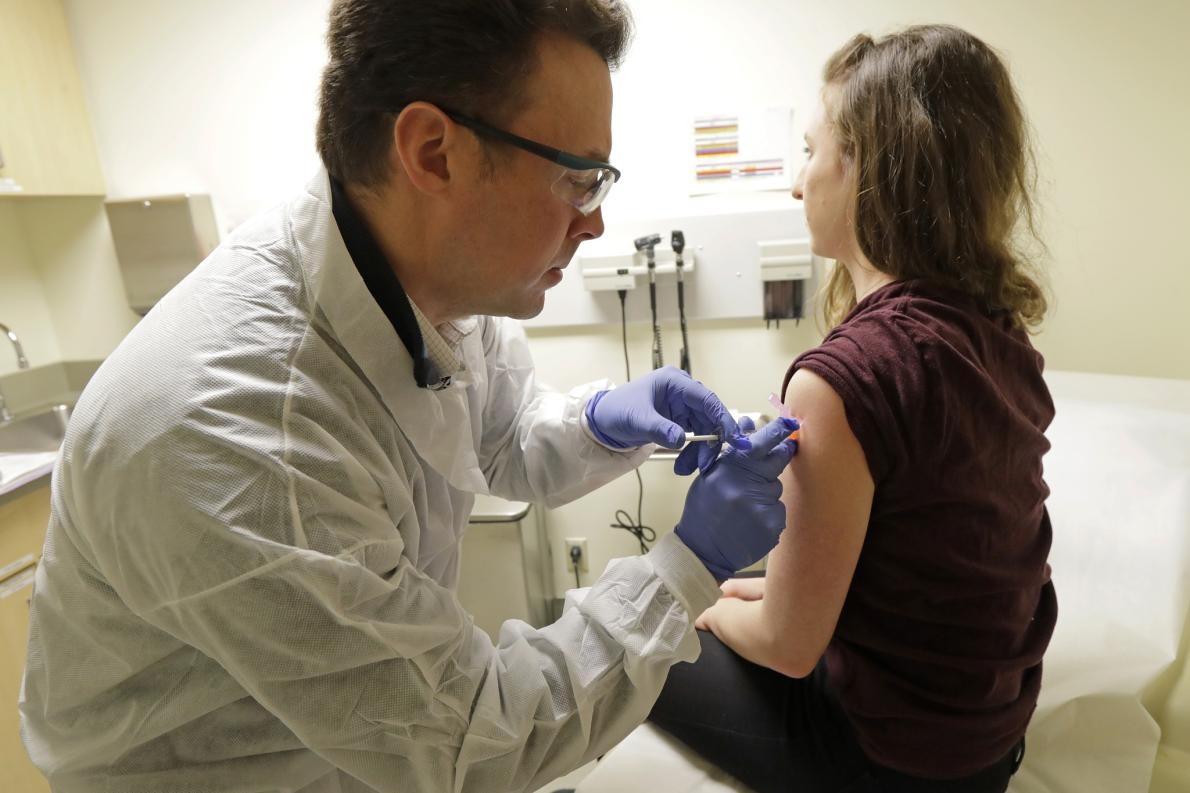
2020年3月16日,藥師麥克.威特(Michael Witte)(左)在一種COVID-19潛在疫苗的臨床試驗第一階段為瑞貝卡.希路爾(Rebecca Sirull)注射疫苗。希路爾是西雅圖凱薩醫療機構華盛頓衛生研究所的研究中第三位接受疫苗的患者,這項試驗的第一階段有三處機構參與,該研究所是其中之一。PHOTOGRAPH BY TED S. WARREN, AP PHOTO
藥物研發人員兼愛荷華大學藥學院教授阿里.薩利姆(Ali Salem)說:「研究結果令人振奮,因為他們的第一階段資料顯示疫苗很安全,這非常重要。」他並未參與莫德納的試驗。
莫德納的第三階段試驗會納入大約3萬名受試者,在分布於美國30州與華盛頓哥倫比亞特區的89個地點進行試驗。試驗目標是確認兩劑mRNA疫苗是否能預防人類感染COVID-19、避免已感染者死去,或者兩種作用兼備。
多專業研究聯盟(Alliance for Multispecialty Research)的行銷總監傑米.法拉(Jaime Farra)說:「我們的試驗主持人肯定會說,這些研究是他們一輩子做過最重要的研究。」該聯盟負責管理一處參與第二階段試驗的地點,現在也正在堪薩斯州牛頓進行第三階段試驗。
然而,第三階段試驗的啟動有點不同尋常,因為莫德納尚未完成從5月底開始的第二階段試驗。第一階段是在健康個體進行的初步安全檢查,而第二階段的目的則是首先表明,疫苗能用於罹患疾病的患者身上。
有些人曾經對加速研發莫德納候選疫苗,作為「曲速行動」(Operation Warp Speed)計畫一部分的決定表示質疑;如果第三階段失敗,就會證明那些人才是正確的。曲速行動這項聯邦計畫是由美國衛生與公共服務部(Department of Health and Human Services)主持,同樣已經為牛津大學的疫苗與嬌生公司研發的一種候選疫苗排定了納入3萬名受試者的第三階段試驗。儘管如此,抱持懷疑態度的人仍認為,鑑於mRNA疫苗時好時壞的研發史,所以快速推進莫德納候選疫苗是一種賭博。
mRNA疫苗是怎麼出現的
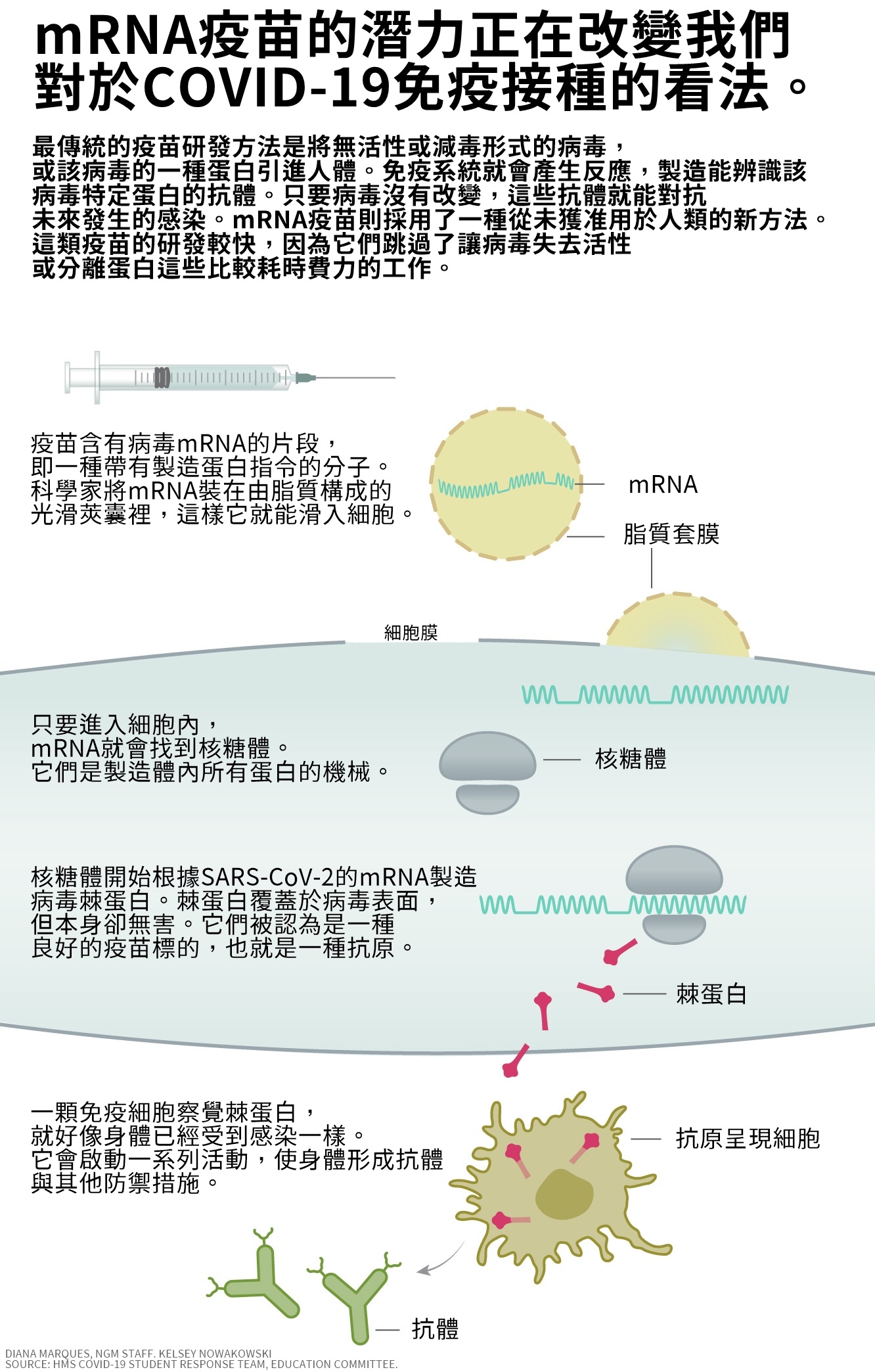
每當病原體感染人體,我們的免疫系統就會搶著辨識病原並啟動反應。傳統疫苗利用了這種反應,方法是注射完整但無活性的病毒或它們的完整蛋白進入人體,引發免疫反應。這些疫苗需要大量時間來研發,部分原因是科學家必須培養病原,並以特定方式讓完整病原或其蛋白失去活性。
傳訊RNA(mRNA)是由核酸構成的遺傳物質──就跟我們的DNA成分相同──它們會在細胞中移動,給予最終指令,讓細胞知道應該製造哪種蛋白來形成身體的細胞結構。1990年代初期,科學家想知道如果他們製造病毒DNA與mRNA片段,然後將其注入人類或實驗動物的細胞,會發生什麼事。他們希望細胞會攝入這些遺傳物質片段,製造病毒蛋白,並引發免疫反應。
理論上,這個方法會讓科學家更快製造疫苗;候選疫苗不需數週時間準備,而是可能在數小時或數天內就進行測試。這些候選疫苗也會更靈活,更能抵抗常常透過突變來演化的病原,例如冠狀病毒、流感病毒、人類免疫缺陷病毒。國際疫苗學會的主席瑪格麗特.劉(Margaret Liu,音譯)說,這可能有助於製造一種廣效型疫苗,預防同一病毒的多種病毒株。
30年前,劉是第一波試圖使用DNA疫苗與mRNA疫苗的實驗室研究人員;她早年關於一種廣效型流感DNA疫苗的成果是第一種顯示出保護力的廣效型疫苗,而且非常有潛力──至少在小鼠身上是如此。整體而言,DNA疫苗與mRNA疫苗的研發初期在動物模型上一再顯示出成功的結果,這個階段被稱為藥物研發的「臨床前」階段,但接著這些疫苗卻無法在人類身上產生強效的免疫反應。
劉說:「人們原本覺得,這一定是因為人類體型比較大。」但在人們成功研發用於馬、魚、加州兀鷲的DNA疫苗之後,這項假設就失去了支持。
另一方面,mRNA疫苗的穩定性卻很弱。一旦進入體內,疫苗中的mRNA就會比DNA更快分解,這也限制了免疫效力。此外,mRNA可能使免疫細胞的狀況惡化,造成不良反應。多年來,這些問題讓mRNA疫苗無法發揮作用,並使DNA疫苗降級到獸醫學領域。
發展中的關鍵
情勢在2005年開始轉變,當時賓州大學的科學家將mRNA疫苗做了輕微的化學性修飾。這些修飾增加了耐久度,並讓疫苗更加安全,導致的不良免疫反應也更少。
愛荷華大學的薩利姆說:「許多人開始將mRNA視為一種用於多種疾病的治療策略。」其中一個分支成為「ModeRNA醫藥公司」,如今稱為莫德納。哈佛大學研究人員德里克.羅西(Derrick Rossi)利用修飾過的mRNA將幹細胞重新編碼,試圖治療心血管疾病,之後這間公司就於2010年成立。
數年來,該公司也開始倚賴一種用於藥物傳輸的熱門工具,稱為脂質奈米粒子(lipid nanoparticles)。藉由把遺傳物質裝進由脂質構成的光滑莢囊,這些粒子能更輕易地把mRNA滑進細胞,然後mRNA就能開始發揮作用。有了更安全的mRNA技術與更佳的藥物運輸,該公司能夠拓展投資組合,研究癌症以及流感等一系列傳染病的治療。但隨著由蚊子傳播的茲卡病毒出現,重大轉折點也到來了。
數十個皇冠狀的棘蛋白(紅色)──冠狀病毒因而得名──從病毒表面突出,使病毒得以感染人類細胞。MODEL AT ATOMIC RESOLUTION IN BY VISUAL SCIENCE
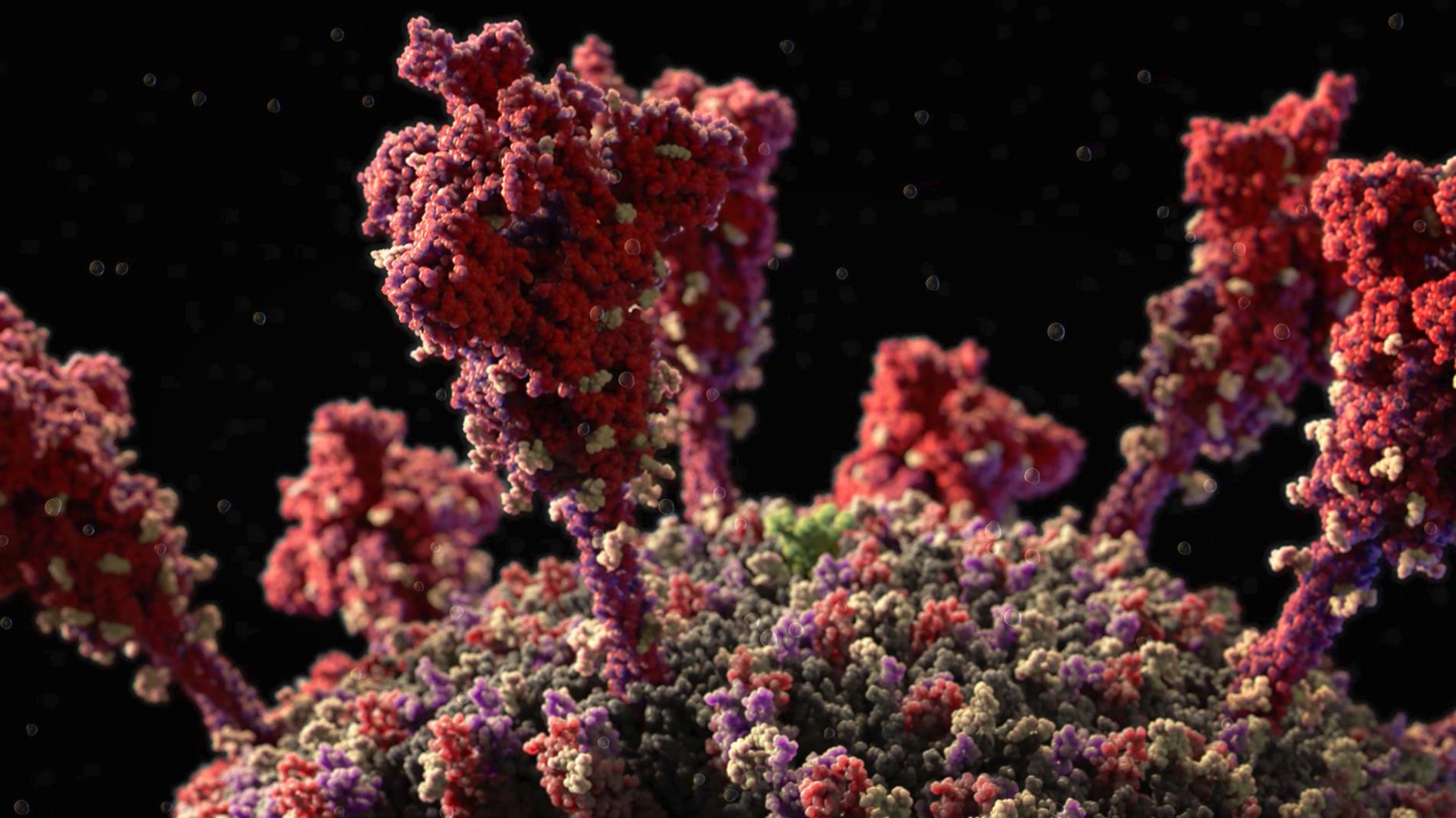
當疫苗促使身體製造中和抗體(白色)之後,這些前哨就會以附著在病毒棘蛋白上的方式來阻擋病毒。為了製造疫苗,我們必須了解病毒的遺傳結構及分子結構。請點這裡觀看關於病毒成分的影片。MODEL AT ATOMIC RESOLUTION IN BY VISUAL SCIENCE
茲卡病毒於2015年出現後,實驗室就急忙尋找適合的疫苗。賈斯汀.利奇諾(Justin Richner)如今是芝加哥伊利諾大學的助理教授,他曾參與一項多所大學聯合計畫,針對莫德納醫藥公司製作的mRNA候選疫苗進行初步研究。利奇諾說,該團隊修飾了mRNA的編碼,使莫德納的一種茲卡疫苗在2016年進入早期人類試驗──但進展到這個階段就停止了。
安全第一
莫德納醫藥公司並未回應《國家地理》多次的採訪請求。但該公司的近況更新報告──這些報告未經過同儕審查──可以提供關於COVID-19疫苗研發進展的線索。舉例來說,雖然莫德納在5月18日的公告沒有提供實質數據,以顯示接種之後人類或小鼠體內出現多少抗體。不過,報告的確顯示該公司的COVID-19試驗第一階段明顯達到初始目標,確認了最安全的藥物劑量。
貝勒醫學院的國家熱帶醫學院副院長瑪麗亞.埃琳娜.波塔奇(Maria Elena Bottazzi)說:「當你將疫苗投入首次用於人類的臨床試驗,要取得的最重要資訊是這支疫苗是否安全。」她沒有參與莫德納的試驗。
↑↑↑↑↑國家地理探索系列:城市曾經是疾病的溫床
她補充說,顯示莫德納是否成功的較佳徵兆,可能是該公司的初期聲明裡沒有提到,但在同儕審查研究報告裡短暫出現的某種東西:T細胞。抗體只是免疫反應的一個分支而已,T細胞是另一個分支。兩者都可以自行構成持久的保護,不過T細胞有助於讓抗體出現。波塔奇說,這件事很重要,因為DNA與mRNA疫苗比較適合激發T細胞,但評估這類反應耗時費力,而且通常會到人類試驗的後期階段才會進行。
儘管如此,莫德納可能還有很長一段路要走。第二階段受試者預計要接受觀察至少15個月,第三階段也預定要到2022年10月才會結束──不過因為疫情大流行,所以如果這些試驗的初步結果很有希望,這種疫苗的許可或許會加快完成。
不論莫德納是否成功,全世界依然需要多種冠狀病毒疫苗來對抗大流行。以全球而言,有超過一百項COVID-19候選疫苗試驗正在進行,而到目前為止,多家公司都報告了很有希望的同儕審查研究結果。波塔奇說,在許多不同地方下賭注最終會是一項優勢,因為如果任何一種候選疫苗失敗,其他疫苗能持續給予希望。
延伸閱讀:她在半世紀前發現了冠狀病毒──卻沒有獲得多少肯定 / 疫苗如何保衛人體?